
北京市药品监督管理局关于执行《免于经营备案的第二类医疗器械产品目录》有关事项的通知
发布时间:2021年08月05日
京药监发〔2021〕186号
北京经济技术开发区管理委员会,各区市场监管局,房山区燕山市场监管分局,市市场监管局机场分局,市药监局各分局,市网监中心:
为贯彻实施新修订的《医疗器械监督管理条例》、《国家药品监督管理局关于公布〈免于经营备案的第二类医疗器械产品目录〉的公告》(2021年第86号),现就有关事项通知如下:
一、关于医疗器械经营备案的管理
自《国家药监局关于公布〈免于经营备案的第二类医疗器械产品目录〉的公告》(2021年第86号)发布之日起,按照《医疗器械监督管理条例》第四十一条的规定执行,仅从事《免于经营备案的第二类医疗器械产品目录》(以下简称《目录》)中品种经营的,仅需取得具有销售医疗器械经营范围的营业执照,不需办理医疗器械经营备案(含医疗器械网络销售),可直接从事经营活动。
二、关于医疗器械分类目录的规范使用
《目录》中产品对应的分类目录为2017版《医疗器械分类目录》,对于经营2002版《医疗器械分类目录》的产品可对照执行(见附表)。
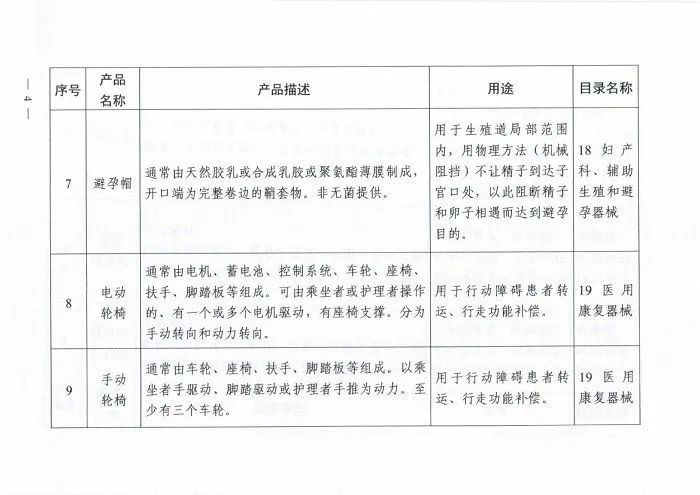
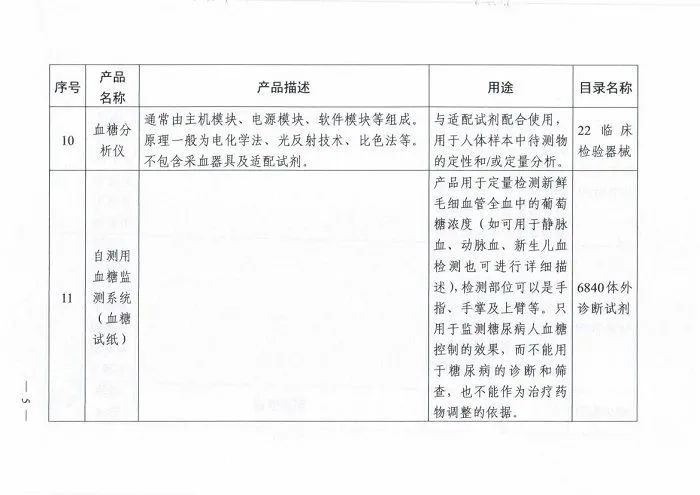
附表.2002和2017版《医疗器械分类目录》产品对照
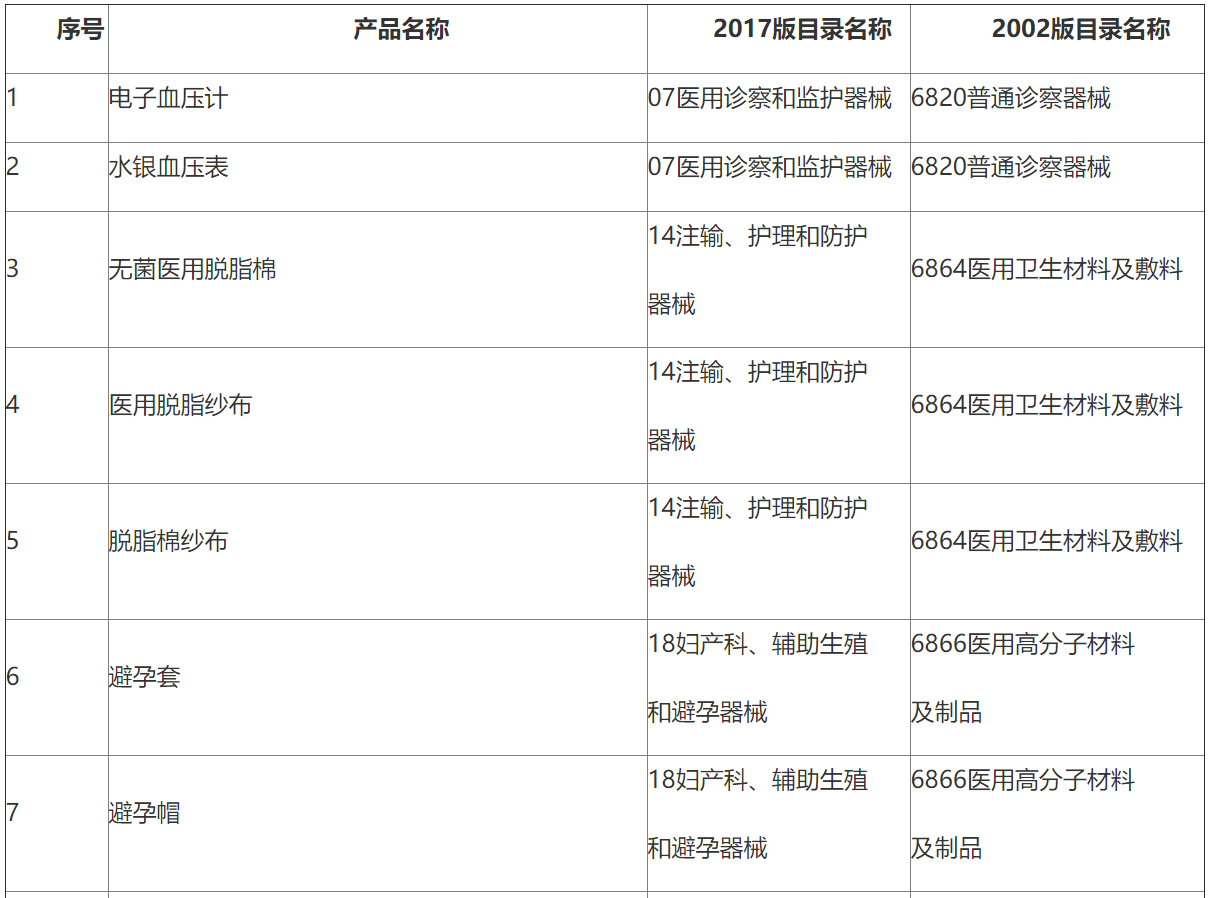
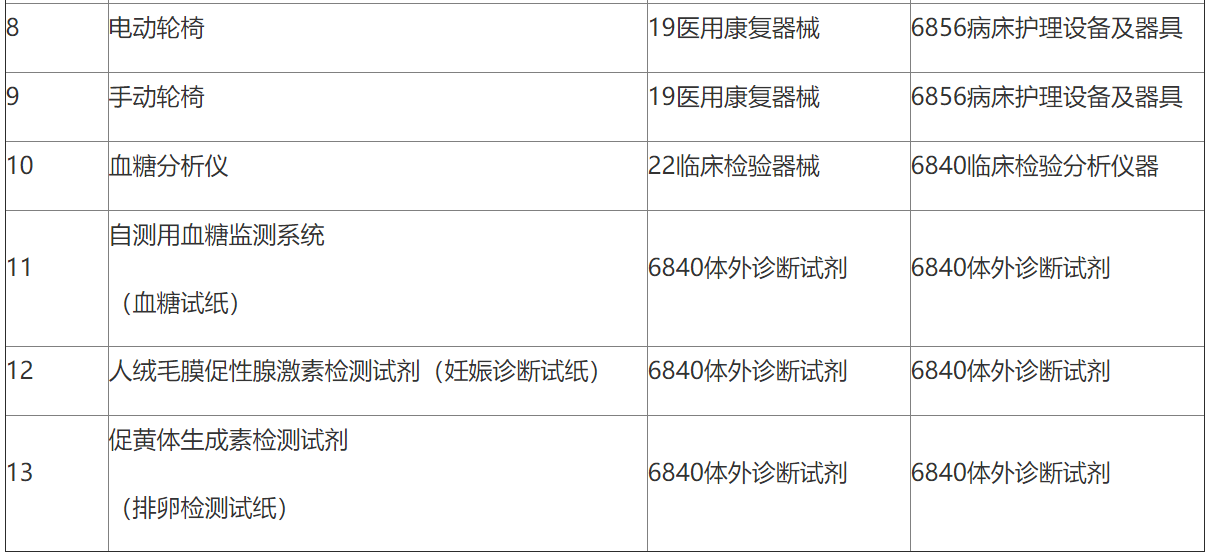
(注:第11项、第12项和第13项医疗器械2002版目录名称和2017版目录名称均按照《6840体外诊断试剂分类子目录(2013版)》执行。)
三、医疗器械网络交易服务第三方平台管理的规定
医疗器械网络交易服务第三方平台应当切实落实质量安全主体责任,履行入驻企业资质及产品资质的审核义务,对于仅从事《目录》中品种经营的企业,仅需要审核营业执照是否具有医疗器械经营范围,不需审核其医疗器械经营备案凭证(含医疗器械网络销售)。
四、有关要求
(一)加强医疗器械经营监督管理工作
各单位要切实加强事中事后监管,充分利用“双随机”、互联网监测、抽验等监管手段,积极探索监管新模式,做好医疗器械风险隐患排查治理,其中对于《目录》中电子血压计、避孕套等群众关心、舆情关注的医疗器械产品,各单位要通过投诉举报、监督检查、抽检监测、网络监测等多渠道收集线索,对发现的违法违规问题,要依法处理,发现重大质量问题或安全事故的,应及时报告市药监局。
(二)做好医疗器械网络监测及线索查处工作
北京市食品药品互联网监测中心要充分利用现有监测手段,结合医疗器械风险隐患排查治理工作,开展《目录》中品种的监测工作。要认真做好违法线索取证和移转工作,对发现的违法行为及时移交执法部门查处。
(三)加强政策宣传和企业质量安全主体责任的落实
各单位要将此公告与新修订的《医疗器械监督管理条例》的宣传贯彻有机结合,加强受理窗口、网上解答多种方式咨询服务、政策解读。积极引导企业诚信经营,加强企业、行业的自律意识,落实企业是第一责任人的责任意识,严格按照新修订的《医疗器械监督管理条例》的规定,依法开展医疗器械经营活动。
特此通知。
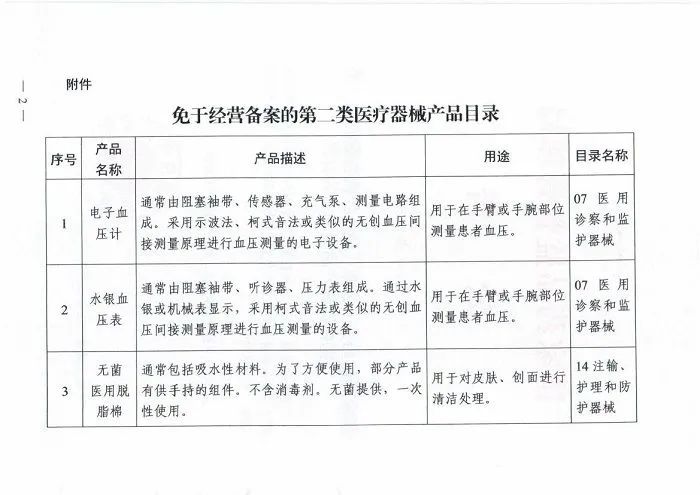
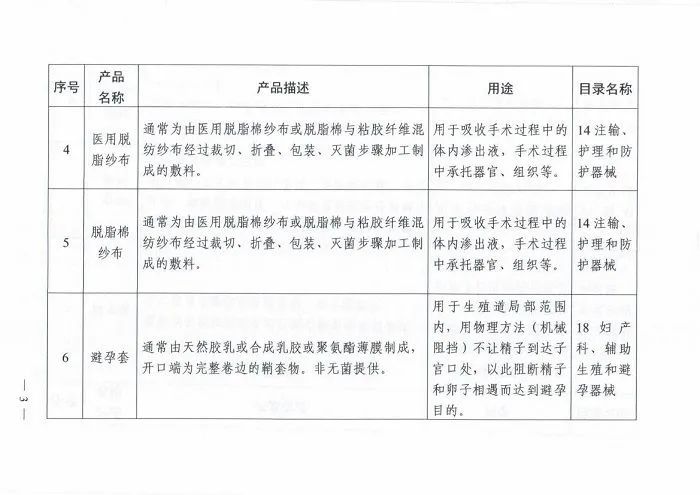
附件:国家药监局关于公布《免于经营备案的第二类医疗器械产品目录》的公告(2021年第86号)
北京市药品监督管理局
2021年8月3日
附件


不代表本站立场。我们转载此文出于传播更多资讯之目的,如涉著作权事宜请联系删除。
